八大贵金属有哪些_八大贵金属有哪些品种
大家好,今天我将为大家详细介绍八大贵金属有哪些的问题。为了更好地呈现这个问题,我将相关资料进行了整理,现在就让我们一起来看看吧。
1.华银贵金属交易中心的产品服务与优势
2.八大币种,都有哪些国家的货币?
3.过去十年里,美元,股票,黄金和房子,哪种投资最可靠
4.[化学]八大元素种族的物理性质跟化学性质
5.贵金属投资有什么优点和缺点?

华银贵金属交易中心的产品服务与优势
华银贵金属交易中心交易 品种为贵金属类,华银贵金属交易中心的产品为华银贵金属交易中心认证的可提供标准企业生产的符合交国家质量标准产品。华银贵金属交易中心推出的实物白银投资银条,成色为Ag9999,指定国内知名生产厂商生产,符合中华人民共和国国家标准GB/T4135—2002,经华银贵金属交易中心认定方可用于交割;会员保证一定现货存量并承诺对售出白银进行回购。目前华银贵金属交易中心已经推出“华银银-50”(50盎司)、“华银银-500”(500盎司)、“华银银-2500”(2500盎司)、和新增“华银银-15kg”四种白银交易产品。 1.平台优势:采用国际现货白银报价单位美元/盎司报价,跟随国际走势,公平、公正、公开。交易、结算为人民币,按照1:6.5的固定汇率折算,降低投资者因为汇率波动带来的风险。
2. 交易资金银行第三方存管,安全可靠,方便快捷
3.交易灵活:每日可以交易数次,可设自动止损止盈,增加获利机会,资金即时到帐有效增加资金利用率,减少投资风险。
4.预付款制度:预付款比例选择多样性,小投资高回报,提高资金利用率,大大增加投资收益率。
5. 可提取实物白银:交易中心的生产类会员将为投资者申请现货交割提供充足的货源保证。
6. 政策支持,合法交易:青岛市政府批准,国务院部级联席会议验收,享受青岛保税港区优惠政策。
7. 交易中心合规稽核: 以政府授予交易中心从事组织、管理的公信力和公权力,对各方经营活动进行监督,规范经营行为,防范经营风险,保证整体交易市场健康良性发展。
交易中心六大核心业务
信息资讯服务华银网上商城
电子商务订货服务
华银白银高峰论坛
华银培训及认证中心
白银品质检验服务
交易中心八大优势
一站式的交易平台
华银贵金属交易中心是集白银实物产品、题材性文化收藏品、白银投资交易、原矿进出口等于一体的电子商务交易平台,打造一个规范的、安全的、快捷的交易平台。
全方位的优质服务
华银贵金属交易中心提供交易、信息、质检、仓储、运输、保险、结算等第三方中介服务,在供需双方充当一个中立者的角色,提供一个公平、公正、公开交易平台。为白银的生产、流通、消费企业提供更现代、更简便、更有效的货物购销流通渠道,极大地帮助相关企业规避现货市场价格波动所带来的经营风险。
创新性的电子商务
华银贵金属交易中心,立足青岛,定位全国市场,建立网络经济,服务实体经济,实现贵金属交易市场的低成本扩张。以小批量交易的尝试,引发大批量交易的潮流,以小带大,产生飓风效应,带动大宗电子商务市场的发展!建立成为诚信、便利、实惠的电子贸易中心。
专业化的信息服务
华银贵金属交易中心通过门户网站发布大量的行业信息促进行业间的沟通,根据交易平台上集中交易产生的价格变动、反映市场的供求变化,提供交易讯息专业化、更新迅速化、数据精准化的信息服务,形成权威、客观、及时的白银行业信息服务中心。
完善的物流服务
华银贵金属交易中心通过提供并不断完善的仓储和运输等物流服务,形成优质、高效、畅通的仓储物流中心,使商品供应环节大幅减少,按需供应、随需采购的可能性不断增加,降低购销过程中的风险,使商品的价值回归理性,促进商品行业的发展。
高效的流转服务
华银贵金属交易中心为客户规范交易资金管理、建立交易双方信用评估体系,增加交易资金的流量、加快流转速度,有效的解决了供应链资金流问题。
便捷的投资服务
华银贵金属交易中心极大的满足了客户的实物购买需求,可以让老百姓便捷的从市场上买到白银,同时也可以将手里的白银变现,随时满足客户的投资、收藏、交易需求。
广泛的合作模式
华银贵金属交易中心,汇聚全国信息、资金、物流,整合资源,获取规模效益,与银行、担保公司、物流公司进行广泛的合作,提升商户交易规模,推动全国商品市场的发展。
交易中心四大创新
营运制度创新
为确保华银贵金属交易中心的健康、规范发展和市场功能的发挥,交易中心将报请政府相关职能部门出面,成立监管委员会,确保交易中心在政府监管委员会的监督指导下依法合规经营;
华银贵金属交易中心协同各类市场参与者共同发起贵金属现货交易协会。该协会将根据行业和市场的发展需求,制定和实施行业自律规范、自我约束和自我监督,创造良好的贵金属现货交易市场环境。
华银贵金属交易中心将邀请国内外著名经济专家和学者、贵金属行业专家、金融行业专家、企业家和相关政府官员成立贵金属现货交易专家顾问委员会,参与交易中心的发展规划、理论研究和经营战略决策,为交易中心的健康发展献计献策,提供交易中心绵绵不断的业务创新能力。
华银贵金属交易中心将通过制度创新,获得交易运营的合法性保障,进一步保护市场参与者的合法权益。
交易模式创新
华银贵金属交易中心将采用现货电子商务预付款系统进行白银商品的买卖。
电子商务预付款买卖系统是华银贵金属交易中心吸收传统现货交易、合同交易、拍卖交易、网上交易、期货交易、中远期电子交易、递延交易等各种交易模式的优点,借助B2B及B2C的成功商业模式而研发的革命易模式,是一种适合生产要素市场和大宗资源商品贸易流通的电子商务形态。该交易模式成功规避了传统交易模式的各种弊端,不仅可以帮助贵金属生产商、批发商、贸易商及客户更快速合理的实现价值,其强大的市场信息传导功能和经济连动功能,势必会对关联企业及客户产生深远影响。
商品融通创新
华银贵金属交易中心与各大银行开展供应链融资合作,为买卖双方融资提供充足的资金保障。
青岛华银贵金属交易中心首创的购销制度使订立了电子买卖合同的卖方,只要将合格的货物交由交易中心指定的存管仓库,交易中心就可以通过银行或相关机构替买方先行支付卖方全额货款,买方可在日后支付全额货款后提货,也可以将电子买卖合同转让给其他买方履行义务;买方订立的电子买卖合同的提货数量只要不超过交易中心公布的库存数量就能及时拿到合格的货物。
华银贵金属交易中心通过商品融通创新,保证了卖家可以卖出商品并及时拿到全额货款,买家能够随时买到合格的商品。
服务模式创新
华银贵金属交易中心采用授权营运中心推广的新模式,为市场各类参与者进行商品服务。营运中心将覆盖全国各级城市,将统一管理、统一标识、统一服务内容、统一服务标准,协助会员完成在交易中心和结算银行的开户、买卖、结算、提货等买卖活动,使华银贵金属交易中心真正成为:最便捷的贵金属购销途径,最出色的资源商品投资工具。
地址:中国·青岛保税区曼谷路55号瑞华楼六楼
八大币种,都有哪些国家的货币?
科威特第纳尔1科威特第纳尔=3.3179美元=21.9018元人民币
巴林第纳尔
1巴林第纳尔=2.6504美元=17.4956元人民币
阿曼里亚尔
1阿曼里亚尔=2.5974美元=17.1452元人民币
塞浦路斯镑(退出市场)
1塞浦路斯镑=1.9247美元=12.7048元人民币
英镑
1英镑=1.338美元=8.832元人民币
欧元
1欧元=1.186美元=7.8232元人民币
瑞士法郎CHF
1瑞士法郎兑换1.034美元/6.8241人民币
8:美元USD?
1美元兑换1美元/6.596人民币。
9:加元CAD?
1加元兑换0.7920美元/5.2266人民币
10:澳元AUD?
1澳元兑换0.7890美元/5.204人民币
扩展资料:
货币CCY(Currency)本质上是一种所有者与市场关于交换权的契约,根本上是所有者相互之间的约定。吾以吾之所有予市场,换吾之所需,货币就是这一过程的约定,它反映的是个体与社会的经济协作关系。
货币的契约本质决定货币可以有不同的表现形式,如一般等价物,贵金属货币,纸币,电子货币等。它可以用作交易媒介、储藏价值、延期支付标准和记帐单位。实物货币是专门在物资与服务交换中充当等价物的特殊商品,是人们的商品价值观的物质附属物和符号附属物。
既包括流通货币,尤其是合法的通货,也包括各种储蓄存款,在现代经济领域,货币的领域只有很小的部分以实体通货方式显示,即实际应用的纸币或硬币,大部分交易都使用支票或电子货币。货币区是指流通并使用某一种单一的货币的国家或地区。
不同的货币区之间在互相兑换货币时,需要引入汇率的概念。在现代经济中,货币起着根本性和基础性的作用。在宏观经济学中,货币不仅是指现金,而且是现金加上一部分有形和无形的资产。
参考资料:
过去十年里,美元,股票,黄金和房子,哪种投资最可靠
美国、加拿大、英国、欧洲、瑞士、中国、日本、澳大利亚。
美元、加元、 英镑、 欧元、瑞士法郎、港币、日元、澳元。这些是世界上八种主要货币。 然而,人民币的重要性现在仅次于英镑和美元。目前,联合国承认的货币有180多种,货币汇率随时波动。 在普通人眼里,“货币”是一种“等价交换”的手段。 您可以使用您所在国家/地区的“货币”购买您所在国家/地区的“等价”商品。 在国际上,一国货币的“地位”在一定程度上影响着其经济发展。
1、货币本质上是所有者之间关于交换权的契约。不同形式的货币在本质上是统一的。过去,由于人们对金钱的本质认识不清,错误地从不同的角度将金钱分为不同的种类。例如,根据货币的商品价值分为债务货币和非债务货币,根据贵金属的兑换比例是否约定,分为可兑换货币和不可兑换货币。
2、形式上,根据货币的商品价值,可分为实物货币和形式货币。实物货币本身是一种特殊的商品,包括价值,如羊、贵金属等;正式货币本身没有价值,其价值是由合同约定的,只有合同价值。两种形式不同,但本质上是统一的,即约定为交换媒介,具有合约价值。货币的购买力取决于货币的合约价值,但实物货币的购买力也会受到其自身商品价值的影响。通常,实物货币的商品价值低于其作为货币的合约价值。
标价方法
1、直接标价法:直接标价法是指将一定单位的外币折算成一定数量的本币的定价方法。 目前,大多数国家采用这种定价方式。 日元、瑞士法郎、加元、港元和新加坡元均采用直接定价方式,如1美元=115.25日元; 1 美元 = 1.47 加元等。
2、间接标价法:间接标价法是指将一定单位的货币兑换成一定数量的外币的定价方法。 欧元、英镑、澳元采用间接定价法,如英镑=1.6025美元; 1 欧元 = 1.5680 加元; 1 欧元 = 1.0562 美元; 1澳元=0.5922美元,以此类推,比如1美元=105日元,即1美元可以兑换105日元。
[化学]八大元素种族的物理性质跟化学性质
建议可以了解下黄金市场,千百年来,多种货币更新交替,黄金却一直得以保值。若是投资实物黄金,推荐可以了解农行的“传世之宝”。
“传世之宝”实物黄金买卖业务是指中国农业银行自主经营,通过指定营业机构(经办网点),与投资者进行“传世之宝”实物黄金产品卖出(销售)和买入(购回)交易的业务。
“传世之宝”以成色为AU9999的黄金原料加工而成,包括金钱和金条两个品种。金钱规格为3克、10克;金条现有20克、50克、100克、200克、500克、1000克六个规格。农行会不定期推出限量版的主题纪念金条,可以点击链接进行了解:传世之宝介绍
或者可以了解下农行的金市通(账户贵金属)业务。
账户贵金属交易业务是农业银行面向个人客户推出的一款账户类交易产品。个人客户可以按照我行提供的账户贵金属买卖价格,通过网上银行、掌上银行进行账户贵金属的即时买卖或委托交易,以赚取投资收益。
业务特点
交易成本低:无开户费,无交易手续费,无需进行实物交割,省去了加工运输流转费用;
交易时间长:支持24小时交易,交易渠道每周一早8:00开市,周六早4:00闭市;
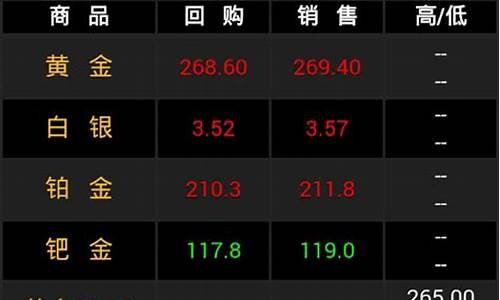
交易品种丰富:客户可以选择人民币或美元作为投资币种,支持黄金、白银、铂金、钯金四个交易品种,组合成八大交易品种,为您提供丰富的投资选择;
交易起点低:人民币黄金、人民币白银、人民币铂金、人民币钯金的交易起点为1克,最小交易单位为1克;美元黄金、美元铂金、美元钯金的交易起点为0.1盎司,最小交易单位为0.1盎司,美元白银的交易起点为1盎司,最小交易单位为1盎司, 少量资金即可投资参与贵金属市场;
支持双向交易:提供先卖出后买入的交易方式,让您在市场下跌的行情中也可获利。
办理流程
个人客户在我行任意网点、网上银行、掌上银行签约后,即可开展账户贵金属交易(在我行网点签约的客户须持本人身份证及借记卡)。
更多理财业务可以点击进入:网页链接
贵金属投资有什么优点和缺点?
0族元素
2 10 18 36 54 86
氦 氖 氩 氪 氙 氡
0族元素由于已经稳定,最外层电子数为8(氦为2),故常以单质气体存在。化学性质极不活泼,除如XeF2等极少数化合物外几乎不与其他物质在任何情况发生化学反应。其中氦、氖没有化合物。
[编辑本段]
各元素概述
元素序号:2
元素符号:He
元素名称:氦
元素原子量:4.003
元素类型:非金属
发现人:杨森
发现年代:1868年
发现过程: 1868年,法国的杨森,最初从日冕光谱内发现太阳中有新元素,即氦。
元素描述: 是惰性元素之一。其单质氦气,分子式为 He,是一种稀有气体,无色、无臭、无味。它在水中的溶解度是已知气体中最小的,也是除氢气以外密度最小的气体。密度0.17847克/升,熔点 -272.2℃(26个大气压)。沸点-268.9℃。它是最难液化的一种气体,其临界温度为-267.9℃。临界压力为2.25大气压。当液化后温度降到-270.98℃以下时,具有表面张力很小,导热性很强,粘性很强的特性。液体氦可以用来得到接近绝对零度(-273.15℃)的低温。化学性质十分不活泼,既不能燃烧,也不能助燃。
元素来源: 氦是放射性元素分裂的产物,α质点就是氦的原子核。在工业中可由还氦达7%的天然气中提取。也可由液态空气中用分馏法从氦氖混合气体中制得。
元素用途: 用它填充电子管、气球、温度计和潜水服等。也用于原子核反应堆和加速器、冶炼、和焊接时的保护气体。
元素辅助资料: 1868年8月18日,法国天文学家詹森赴印度观察日全食,利用分光镜观察日珥,从黑色月盘背面如出的红色火焰,看见有彩色的彩条,是太阳喷射出来的帜热其他的光谱。他发现一条**谱线,接近钠光谱总的D1和D2线,日食后,他同样在太阳光谱中观察到这条黄线,称为D3线。1868年10月20日,英国天文学家洛克耶也发现了这样的一条黄线。
经过进一步研究,认识到是一条不属于任何已知元素的新线,是因一种新的元素产生的,把这个新元素命名为 helium,来自希腊文helios(太阳),元素符号定为He。这是第一个在地球以外,在宇宙中发现的元素。为了纪念这件事,当时铸造一块金质纪念牌,一面雕刻着驾着四匹马战车的传说中的太阳神阿波罗(Apollo)像,另一面雕刻着詹森和洛克耶的头像,下面写着:1868年8月18日太阳突出物分析。
过了20多年后,莱姆塞在研究钇铀矿时发现了一种神秘的气体。由于他研究了这种气体的光谱,发现可能是詹森和洛克耶发现的那条黄线D3线。但由于他没有仪器测定谱线在光谱中的位置,他只有求助于当时最优秀的光谱学家之一的伦敦物理学家克鲁克斯。克鲁克斯证明了,这种气体就是氦。这样氦在地球上也被发现了。
元素序号:10
元素符号:Ne
元素名称:氖
元素原子量:20.18
元素类型:非金属
发现人:莱姆塞、特拉威斯
发现年代:1898年
发现过程: 1898年,英国的莱姆塞、特拉威斯蒸发液体氢时,在最先溢出的气体光谱中发现了氖。
元素描述: 稀有气体元素之一,无色,无臭,无味,气体密度0.9092克/升,液体密度 1.204克/厘米3,熔点-248.67℃,沸点-245.9℃,化学性质极不活泼,电离能21.564电子伏特,不能燃烧,也不助燃,在一般情况下部生成化合物,气态氖为单原子分子,氖还有一个特殊性质是气体与液体体积之比,大多数深冷液态气体在室温条件下产生500到800体积的气体,而氖则生成大于1400体积的气体。这就为它的贮藏和运输带来方便。100升空气中含氖约1.818毫升。
元素来源: 由空气分离塔在制取氧氮气的同时,从中可以提取氖氦的混合气体,在经液氢冷凝法或活性炭硅胶的吸附作用,便可得到氖。
元素用途: 大量用于高能物理研究,让氖充满火花室来探测和微粒的行径。也是制造霓虹灯和指示灯的好原料,和氩混合使用会有美丽的蓝光产生,也可用来填充水银灯和钠蒸气灯。液体氖还用来做制冷剂。
元素辅助资料:莱姆塞在发现氩和氦后,研究了它们的性质,测定了它们的原子量。接着他考虑它们在元素周期表中的位置。因为,氦和氩的性质与已发现的其他元素都不相似,所以他提议在化学元素周期表中列入一族新的化学元素,暂时让氦和氩作为这一族的成员。他还根据门捷列夫提出的关于元素周期分类的假说,推测出该族还应该有一个原子量为20的元素。
在1896~1897年间,莱姆塞在特拉威斯的协助下,试图用找到氦的同样方法,加热稀有金属矿物来获得他预言的元素。他们试验了大量矿石,但都没有找到。最后他们想到了,从空气中分离出这种气体。但要将空气中的氩除去是很困难的,化学方法基本无法使用。只有把空气先变成液体状态,然后利用组成它成分的沸点不同,让它们先后变成气体,一个一个地分离出来。把空气变成液体,需要较大的压力和很低的温度。而正是在19世纪末,德国人林德和英国人汉普森同时创造了致冷机,获得了液态空气。1898年5月24日莱姆塞获得汉普森送来的少量液态空气。莱姆塞和特拉威斯从液态空气中首先分离出了氪。接着他们又对分离出来的氩气进行了反复液化、挥发,收集其中易挥发的组分。1898年6月12日他们终于找到了氖(neon),元素符号Ne,来自希腊文neos(新的)。
元素序号:18
元素符号:Ar
元素名称:氩
元素原子量:39.95
元素类型:非金属
发现人:瑞利
发现年代:1894年
发现过程: 1894年,英国的瑞利,从空气中除去氧、氮后,在对少量气体做光谱分析时发现氩。
元素描述: 其单质为无色、无臭和无味的气体。是稀有气体中在空气中含量最多的一个,100升空气中约含有934毫升。密度1.784克/升。熔点-189.2℃。沸点-185.7度。电离能为15.759电子伏特。化学性极不活泼,按化合物这个词的一般意义来说,它是不会形成任何化合物的。氩不能燃烧,也不能助燃。
元素来源: 可从空气分馏塔抽出含氩的馏分经氩塔制成粗氩,再经过化学反应和物理吸附方法分出纯氩。
元素用途: 氩的最早用途是向电灯泡内充气。焊接和切割金属也使用大量的氩。用作电弧焊接不锈钢、镁、铝和其他合金的保护气体。
元素辅助资料: 19世纪末期,英国物理学家瑞利勋爵发现利用空气除杂制得的氮气和从氨制得的氮气的密度有大约是千分之一的差别。他在当时很有名望的英国《自然》杂志上发表了他的发现,并请大家帮他分析其中的原因。伦敦大学化学教授莱姆塞推断空气中的氮气里可能含有一种较重的未知气体。他们两人又各自做了大量的实验,终于发现了在空气中还存在一种密度几乎是氮气密度一倍半的未知气体。
1894年8月13日,英国科学协会在牛津开会,瑞利作报告,根据马丹主席的建议,把新的气体叫做argon(希腊文意思就是“不工作”、“懒惰”)。元素符号Ar。
当然,当时发现的氩,实际上是氩和其他惰性气体的混合气体,正是因为氩在空气中存在的惰性气体的含量占绝对优势,所以它作为惰性气体的代表被发现。
氩的发现是从千分之一微小的差别开始的,是从小数点右边第三位数字的差别引起的,不少化学元素的发现,许多科学技术的发明创造,都是从这种微小的差别开始的。
元素序号:36
元素符号:Kr
元素名称:氪
元素原子量:83.80
元素类型:非金属
发现人:莱姆塞、特拉威斯
发现年代:1898年
发现过程: 1898年,英国的莱姆塞和特拉威斯用光谱分析液态空气蒸发后所剩下的残余气体时,发现了氪。
元素描述: 无色、无嗅、无味。密度3.736克/升(气),2.155克/厘米 3(液,-156.9℃)。熔点-156.6℃,沸点-152.30±0.10℃。第一电离能13.999电子伏特。氪原子的外壳是电子已填满了的稳定结构。所以它的化学性质极不活泼,不能燃烧,也不能助燃。具有能吸收X射线的性能。
元素来源: 100升空气中约含氪0.114毫升,可从大型的空气液化分离塔内,在制氧或氮的同时抽出的馏分中分出制得。
元素用途: 主要用来充填电灯和各种电子器件。也可作X射线工作时的遮光材料。它和氩的混合物广泛用于充填萤光灯。
元素辅助资料:莱姆塞在发现氩和氦后,研究了它们的性质,测定了它们的原子量。接着他考虑它们在元素周期表中的位置。因为,氦和氩的性质与已发现的其他元素都不相似,所以他提议在化学元素周期表中列入一族新的化学元素,暂时让氦和氩作为这一族的成员。他还根据门捷列夫提出的关于元素周期分类的假说,推测出该族还应该有原子量为20、82、129的元素。
在1896~1897年间,莱姆塞在特拉威斯的协助下,试图用找到氦的同样方法,加热稀有金属矿物来获得他预言的元素。他们试验了大量矿石,但都没有找到。最后他们想到了,从空气中分离出这种气体。但要将空气中的氩除去是很困难的,化学方法基本无法使用。只有把空气先变成液体状态,然后利用组成它成分的沸点不同,让它们先后变成气体,一个一个地分离出来。把空气变成液体,需要较大的压力和很低的温度。而正是在19世纪末,德国人林德和英国人汉普森同时创造了致冷机,获得了液态空气。1898年5月24日莱姆塞获得汉普森送来的少量液态空气。莱姆塞和特拉威斯从液态空气中成功分离出了一种新气体。莱姆塞决定把它叫做krypton(Kr),来自希腊文krptos(隐藏)。
元素序号:54
元素符号:Xe
元素名称:氙
元素原子量:131.3
元素类型:非金属
发现人:莱姆塞、特拉威斯
发现年代:1898年
发现过程: 1898年,英国的莱姆塞和特拉威斯,在分馏液态氪时发现了氙。
元素描述: 无色、无嗅、无味。是惰性气体的一种。密度5.887±0.009克/ 升,3.52克/厘米3(液),2.7克/厘米3(固)。熔点-111.9℃,沸点-107.1±3℃。电离能12.130电子伏特。是非放射性惰性气体中唯一能形成在室温下稳定的化合物的元素,能吸收X射线。在较高温度或光照射下可与氟形成一系列氟化物如XeF2、XeF4及XeF6等。氙也能与水、氢醌和苯酚一类物质形成弱键包合物。
元素来源: 从大型的空气液化分离塔内,在制氧或氮的同时抽出的馏分中分出。
元素用途: 由于它具有极高的发光强度,在照明技术上用来充填光电管、闪光灯合氙气高压灯。氙气高压灯具有高度的紫外光辐射,可用于医疗技术方面。
元素辅助资料:莱姆塞在发现氩和氦后,研究了它们的性质,测定了它们的原子量。接着他考虑它们在元素周期表中的位置。因为,氦和氩的性质与已发现的其他元素都不相似,所以他提议在化学元素周期表中列入一族新的化学元素,暂时让氦和氩作为这一族的成员。他还根据门捷列夫提出的关于元素周期分类的假说,推测出该族还应该有原子量为20、82、129的元素。
1898年,莱姆塞在特拉威斯的协助下先后发现了氪、氖。后来,由于获得新式空气液化设备的帮助,他们制备了大量的氪和氖,反复几次液化、挥发,在同年7月12日从其中又分离出一种惰性气体氙xenon(Xe),来自希腊文xenos(奇异的)。
元素序号:86
元素符号:Rn
元素名称:氡
元素原子量:[222]
元素类型:非金属
发现人:多恩(F.E.Dorn)
发现年代:1900年
发现过程: 1900年由德国人多恩(F.E.Dorn)在铀制品中发现。
元素描述: 第一电离能10.748电子伏特。无色气体。密度9.73克/升。熔点-71℃,沸点-61.8℃。易被吸附在活性碳、硅胶和其他吸附剂上,从而可从气体杂质中分离出来;加热到约350℃,又可从活性碳上脱附。溶于水。
元素来源: 由镭、钍等放射性元素蜕变而获得。
元素用途: 由于氡具有放射性,衰变后成为放射性钋和α粒子,因此可供医疗用。用于癌症的放射治疗;用充满氡气的金针插进生病的组织,可杀死癌细胞。
元素辅助资料: 物理学和化学家们在研究物质的放射性时发现,放射物质周围的空气也会变得具有放射性。
19世纪末,科学家们发现了钍不断放出一种气态的放射性物质,并确定它是化学惰性的,并且具有较高的原子量。由于来自于钍,就称它为钍射气,符号为ThEm。1918年德国化学家施密特按惰性气体氩、氖等命名方式,称它为thoron,元素符号定为Tn,正式承认它是一种元素。1900年德国物理学家多恩同样发现了镭射气radium emantion,符号为RaEM。1918年,施密特又把它改称radon,元素符号定为Rn。另外在1903年,还发现一种锕射气actinium emantion, AcEm;以及一种惰性气体niton。后来人们发现钍射气是氡220,锕射气是氡219,niton是氡222。
氡是地壳中放射性铀、镭和钍的蜕变产物,是一种惰性气体,因此地壳中含有放射性元素的岩石总是不断的向四周扩散氡气,使空气中和地下水中多多少少含有一些氡气。强烈地震前,地应力活动加强,氡气不仅运移增强,含量也会发生异常变化,如果地下含水层的地应力作用下发生形变,就会加速地下水的运动,增强氡气的扩散作用,引起氡气含量的增加,所以测定地下水中氡气的含量增加可以作为一种地震前兆。
由于氡是一种放射性元素,如果长期呼吸高浓度氡气,将会造成上呼吸道和肺伤害,甚至引发肺癌。氡为19种致癌物质之一。
氧族元素
氧族元素是元素周期表上的ⅥA族元素(IUPAC新规定:16族)。
这一族包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素,其中钋为金属,碲为准金属,氧、硫、硒是典型的非金属元素。在标准状况下,除氧单质为气体外,其他元素的单质均为固体。
在和金属元素化合时,氧、硫、硒、碲四种元素通常显-2氧化态;但当硫、硒、碲处于它们的酸根中时,最高氧化态可达+6。
一些过渡金属常以硫化物矿的形式存在于地壳中,如FeS2、ZnS等。氧、硫、硒的单质可以直接与氢气化合,生成氢化物.例如,硫与氢气反应时,生成硫化氢.
一.原子结构的异同点
1.原子结构的相同点.(1)原子最外层有6个电子.
(2)反应中易得到2个电子.
(3)表现氧化性.
2.原子结构的不同点.
(1)核电荷数依次增大.
(2)电子层数依次增大.
(3)原子半径依次增大,得电子能力依次减弱,氧化性依次减弱.
二.单质的化学性质
1.相似性
(1)能与大多数金属反应.
(2)均能与氢化合生成气态氢化物.
(3)均能在氧气中燃烧.
(4)氧化物对应的水化物为酸.
(5)都具有非金属性.
2.递变性(从氧-->碲)
(1)气态氢化物的稳定性逐渐减弱.
(2)气态氢化物的还原性逐渐增强.
(3)气态氢化物水溶液的酸性逐渐增强.
(4)最高价氧化物对应水化物酸性逐渐减弱.
(5)非金属性逐渐减弱.
氧(O) 硫(S) 硒(Se) 碲(Te)
核电荷数 8 16 34 52
常温色态 无色气体 淡黄固体 灰色固体 银白固体
熔、沸点 → 依次升高
化合价 -2 -2、+4、+6 -2、+4、+6 -2、+4、+6
与H2反应 爆炸 加热 加热 ╱
H2R稳定性 1000℃ 300℃ 加热易分解 极易分解
最高价水化物 ╱ H2SO4 H2SeO4 H2TeO4
碳族元素
位于元素周期表中ⅣA族,包括碳C、硅Si、锗Ge、锡Sn、铅Pb五种元素。价电子层构型为ns2np2,有4个价电子。碳、硅是非金属,锡、铅是金属,锗是半金属。特殊的结构使其获得电子与失去电子的能力几乎相等,往往通过电子的共用达到稳定结构,当与其它元素的原子化合时,主要形成共价型化合物。
碳和硅在自然界中分布很广,碳的含量并不多,但它是地上化合物种类最多的元素。硅在地壳中的含量仅次于氧。
游离态的碳以金刚石和石墨两种单质形式存在,硅以化合态存在于二氧化硅和硅酸盐中,锗、锡主要以氧化物形式存在(锗石GeO2、锡石SnO2)、铅以硫化物存在居多。铅单质为金属晶体,其它四种元素的单质为原子晶体(石墨为层状晶体、白锡为金属晶体)。空气中的二氧化碳、地壳中各种碳酸盐、煤、石油里都含有大量的碳,脂肪、糖类、蛋白质及其它有机物都是含碳的化合物。碳和锡都有同素异形体(金刚石、石墨和碳-60,灰锡和白锡等)。
本族元素随着原子序数的增加,电子层数逐渐增加,原子核对外层电子的引力逐渐减弱,非金属性逐渐减弱(得电子能力减弱),金属性逐渐增强(失电子能力增强)。化学性质差异很大。
1.碳可以跟浓硫酸、硝酸反应,被氧化成二氧化碳,不与盐酸作用。硅不跟盐酸、硫酸、硝酸作用,只与氢氟酸反应。锗不和稀盐酸、稀硫酸反应,但能被浓H2SO4、浓HNO3氧化。锡和稀盐酸、稀H2SO4反应,生成低价锡Sn(Ⅱ)的化合物;跟浓H2SO4、浓HNO3反应生成高价锡Sn(Ⅳ)的化合物。铅跟盐酸、硫酸、硝酸都能反应被氧化成Pb2+。
2. 跟碱溶液反应的有硅和锡,如生成SiO3,2-,放出氢气,表明锡不全是金属性的。
3.在加热时都能跟氧反应,被氧化成CO2、SiO2和PbO等。
4.跟硫、氯共热生成相应的高价氯化物和硫化物,铅则生成PbS和PbCl2。
5.碳、硅跟金属共热生成碳化物和硅化物,锡、铅与金属形成合金。都不能直接与氢化合,其氢化物是间接制得的。
铂族元素
| [<<] [>>]
矿物分类中,铂族元素矿物属自然铂亚族,包括铱、铑、钯和铂4种自然元素矿物。它们彼此之间广泛存在类质同象置换现象,从而形成一系列类质同象混合晶体。同时,其成分中常有铁、铜、镍、银等类质同象混入物,当它们的含量较高时,便构成相应的殓种。铂族元素旷物均为等轴晶系,单晶体极少见,偶而呈立方体或八面体的细小晶粒产出。一般呈不规则粒状、树枝状、葡萄状或块状形态。颜色和条痕为银白色至钢灰色,金属光泽,不透明,无解理,锯齿状断口,具延展性,为电和热的良导体。由铂族元素矿物熔炼的金属有钯金、铱金、铂金、铑金、等。
1.钯金:主要由自然钯熔炼而成。颜色银白色,外观与铂金相似,金属光泽。 硬度4~4.5。相对密度12。熔点为1555℃。化学性质较稳定。因产量比铂金和黄金大,故价值低,很少用来制作首饰。
2.铑金:主要由自然铑提炼而成,是一种稀少的贵金属。颜色为银白色, 金属光泽,不透明。硬4~4.5,相对密度12.5。熔点高,为1955℃。化学性赏稳定。由於铑金耐腐蚀,而且光泽好,因此主要用於电镀业,将其电镀在其它金属表面,镀层色泽坚固,不易磨损,反光效果好。
3.铱金:主要由自然铱或铱矿提炼而成。颜色为银白色,具强金属光泽,硬度7 。相对密度22.40 ,性脆但在高温下可压成箔片或拉成细丝,熔点高,达2454℃。化学性质非常稳定。主要用於制造科学仪器、热电偶、电阻绫等。高硬度的铁铱和铱铂合金,常用来制造笔尖和铂金首饰。
4.铂金:由自然铂、粗铂矿等矿物熔拣而成。因"铂"由"金"和"白"两字组合,颜色又为银白色,故亦称“白金”。色泽银白,金属光泽,硬度4~4.5, 相对密度为21.45。熔点高,为1773℃。富延展性,可拉成很细的铂丝,轧成极薄的铂箔。化学性质极稳定,不溶於强酸强缄,在空气中不氧化。广泛用於珠宝首饰业和化学工业中,用以制造高级化学器皿、铂金坩锅以及加速化学反应速度的催化剂等。
第十六章 硼族元素
本章摘要
1. 单质 硼烷 硼的含氧化合物 硼与硅的相似性
2. 铝Al2O3的两种变体 铝盐
3. 镓 铟 铊 单质 氧化物及氢氧化物 盐类Tl(III)的氧化性
§0. 概述
硼族元素位于III A 族,价电子构型为ns2np1
硼 B 以硼酸盐矿物存在
铝 Al 以Al-O键存在,矿物以铝矾土(Al2O3)最为广泛, 第3位
镓 Ga 与Zn, Fe, Al, Cr等矿共生
铟 In 与闪锌矿共生
铊 Tl 与闪锌矿共生
Ga, In, Tl 属稀散元素,无单独矿藏
§1.硼
一.单质 黄棕色固体,高硬度,高沸点,原子晶体,结构单元B12二十面体
1.制备: 用Mg或Al 还原B2O3:
B2O3 + 3Mg === 3MgO + 2B (高温)
用H2还原三溴化硼:
2BBr3 + 3H2 === 2B + 6HBr (W丝, 高温)
2. 硼的反应
常温下不活泼,高温下活泼
4B + 3O2 === 2B2O3
2B + 3Cl2 === 2BCl3
2B + N2 === 2BN
和氧化性酸起反应,比硅活泼些
B + 3HNO3(浓) ==== H3BO3 + 3NO2
和强碱起反应
2B + 2NaOH(浓) + H2O ===2NaBO2 + 3H2(气体) (偏硼酸钠)
二 硼烷
硼氢化合物虽没有碳氢化合物种类多, 但远比硅烷多. 其结构比烷烃,硅烷复杂.
结构
最简单的硼烷,分子式是B2H6, 分子化学键如下:
端基上的H和B之间形成σ键(sp3-s). 四个端H和两个B形成分子平面,中间两个H不在分子平面内,其连线垂直于分子平面,上下各一个, 上面的H所成的键
共用价电子44个
乙硼烷制备
质子置换法:
相当于Mg2Si和盐酸反应制备SiH4.
还原法:
4BCl3 + LiAlH4 === 2B2H6 + 3LiCl + 3AlCl3
乙硼烷的性质
1° 稳定性
B2H6 === 2B +3 H2
B2H6要在100℃以下保存,稳定性不如硅烷.
2 °还原性
B2H6 + 3O2 === B2O3 + H2O 自燃
属高能燃料,但毒性极大,不易储存.
3 °水解性
B2H6 + 6H2O===2B(OH)3 + 6H2(气体)
4 °路易斯酸的反应,缺电子反应
B2H6 + 2LiH === 2Li(BH4) 白色固体,火箭推进剂
三 硼的含氧化合物
三氧化二硼
单质硼燃烧或硼酸脱水得B2O3,无色晶体.
B2O3 + 3H2O ===2H3BO3 硼酸酐
B2O3和水蒸气反应生成易挥发的偏硼酸:
B2O3 + HH2O === 2HBO2
B2O3和许多种金属氧化物在熔融时生成有特征颜色的硼珠,可用于鉴定.
CoO + B2O3 === Co(BO2)2 深蓝色
Cr2O3的硼珠 绿色 CuO的硼珠 蓝色
MnO的硼珠 紫色 NiO的硼珠 绿色
Fe2O3的硼珠 **
2. 硼酸 H3BO3
2 °弱酸性
缺电子结构造成的:
在H3BO3中加入甘油(丙三醇),酸性可增强,原因是显酸性的机理发生了变化:
H3BO3遇到某种比它强的酸时,有显碱性的可能:
B(OH)3 + H3PO4==== BPO4 + 3H2O (中和反应)
3°硼酸的鉴定反应
点燃时: 硼酸三乙酯燃烧显绿色火焰
3. 硼砂
硼砂是硼的最主要的含氧酸盐, 白色, 玻璃光泽.
因此硼砂和过渡金属氧化物Cr2O3, CuO, MnO, NiO, Fe2O3等也发生硼珠反应, 而实际上的硼珠反应是用硼砂来做.
2°硼砂的水解
生成等物质的量硼酸和硼酸盐, 形成缓冲溶液. 0.01的硼砂溶液pH= 9.24.
四 硼与硅的相似性
相似性
除硼与硅氧化物及含氧酸不相似以外,硼与硅单质的制备, 与酸碱的作用, 氢化物的制备与性质等都相似.
硼和硅的卤化物水解性也相似:
SiCl4 + 4H2O === H4SiO4 + 4HCl
BCl3 + 2H2O === HBO2 + 3HCl
3SiF4 + 4H2O === H4SiO4 + 2H2SiF6 氟硅酸
4BF3 + 2H2O === HBO2 + HBF4 氟硼酸
对角线规则
向下金属性加强,向右非金属性加强,向右向下金属性非金属性相近. 实质是原子或离子的电场力引起的, 电场力相近, 对外层 电子的约束力相近
所以, Li-Mg, Be-Al, B-Si的性质相近
§2.铝
铝单质和酸碱的反应,还原性,化合物酸碱性, 铝的冶炼中学全部讲过.
一.Al2O3的两种变体
γ-Al2O3: 由Al(OH)3脱水制得,是既可溶于酸, 又可溶于碱的Al2O3.
-Al2O3: 若将-Al2O3 高温灼烧, 则变成-Al2O3. -Al2O3 既不溶于酸也不溶于碱. 和KHSO4共熔时转变为可溶物. 其实相当于K2S2O7的熔矿作用
二 铝盐
向Al3+溶液中滴加Na2CO3得Al(OH)3沉淀, 不能得Al2(CO3)3;
加Na2S也得Al(OH)3沉淀, 不能得Al2S3.
水溶液中不能结晶出AlCl3无水盐, 制无水AlCl3要用干法
2Al + 3Cl2=== 2AlCl3 或
Al2O3 + 3Cl2 + 3C === 2AlCl3 + 3CO(气体)
除了铝的氟化物是离子晶体外, 其余卤化物共价性强, 所以熔点沸点较低.
气相AlCl3, 有双聚分子, 有配位键, 或认为中央是形成三中心四电子的氯桥键.
§3.镓 铟 铊
单质
1. 物理性质
Ga, In, Tl都是银白色的软金属, 比铅软.m.p.都很低. Ga熔点29.78℃, 但b.p.为2403℃, 以液相存在的温度范围最大. Hg处于液体的温度范围: -38 ~ 356℃
2. 化学性质
和非氧化性酸反应
2Ga + 3H2SO4 === Ga2(SO4)3 + 3H2(气体) III价 (In的反应相同)
2Tl + H2SO4 === Tl2SO4 + H2 (气体) I价
和氧化性酸反应
Ga + 6HNO3 === Ga(NO3)3 + 3NO2 + 3H2O (In的反应相同)
Tl + 2HNO3 === TlNO3 + NO2 + H2O 不能将Tl氧化到Tl(III)
和碱反应
2Ga + 2NaOH + 2H2O=== 2NaGaO2 + 3H2(气体) 两性
二 氧化物及氢氧化物
* Ga2O3和Ga(OH)3两性偏酸;
*Ga(OH)3可溶于NH3·H2O, Al(OH)3 不溶于NH3·H2O, 所以Ga(OH)3的酸性比Al(OH)3强.
* In2O3和In(OH)3几乎无两性表现, In2O3溶于酸, 但不溶于碱.
按Ga(OH)3, In(OH)3, Tl(OH)3顺序, 越来越易脱水, 生成氧化物:
2M(OH)3 === M2O3 + 3H2O (In2O3黄)
以致于Tl(OH)3几乎不存在.
* Tl2O3易分解:
Tl2O3(棕色) === Tl2O(黑色) + O2 (加热)
* Tl2O易溶于水,形成TlOH也易溶于水:
Tl2O(黑) + H2O === 2TlOH(黄)
* 氢氧化物中, TlOH是强碱(不如KOH); Ga(OH)3酸性最强
三 盐类Tl(III)的氧化性
Tl有(III)和(I)的盐及化合物, Ga(I)和In(I)难生成, 而Al(I)不存在. MF3为离子型化合物, 其余卤化物为共价型, b.p.低, 由于惰性电子对效应, Tl(III)有较强的氧化性.
TlX与AgX相似, 难溶, 光照分解; Tl(I)与变形性小的阴离子成盐时, 与K+,Rb+等相似, 如Tl2SO4易溶于水, 易成矾
贵金属投资主要有抗通胀、有避险属性、价格透明、市场流动性好、交易时间长等优点;参与贵金属交易的投资者需注意掌握相关交易规则与风险控制,尤其要把控资金管理与杠杆使用程度。
如您有进一步了解专业金融市场本外币资产配置方案,随时享受交易、行情、咨询、策略、金融日历等众多金融服务,可在应用商城搜索并下载“E融汇”,即可享受全方位个人资产管理优质服务体验。
以上内容供您参考,业务规定请以实际为准。
如有疑问,欢迎咨询中国银行在线客服。
诚邀您下载使用中国银行手机银行APP或中银跨境GO APP办理相关业务。
好了,今天关于“八大贵金属有哪些”的话题就到这里了。希望大家通过我的介绍对“八大贵金属有哪些”有更全面、深入的认识,并且能够在今后的学习中更好地运用所学知识。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。